PESO ATÓMICO Y MASA MOLAR.

Masa atómica y masa molecular.
Masa atómica. Vienen recogidas en la tabla periódica. Puede expresarse en unidades de masa atómica (uma) o en gramos. Cuando se expresa en uma nos referimos a la masa de un sólo átomo, mientras que si se hace en gramos la masa atómica hace referencia al NA de átomos. Ej: Ma(H) = 1, Ma(C) = 12, Ma(N) = 14, Ma(O) = 16.
Masa molecular. Se calcula mediante la suma de las masas atómicas de los átomos que constituyen la molécula. Puede expresarse en uma o en gramos. Cuando se expresa en uma nos referimos a la masa de una molécula, mientras que si se hace en gramos la masa molecular se refiere al NA de moléculas. Ej: Mm(H2O) = 18, Mm(H2) = 2, Mm(HNO2) = 47.

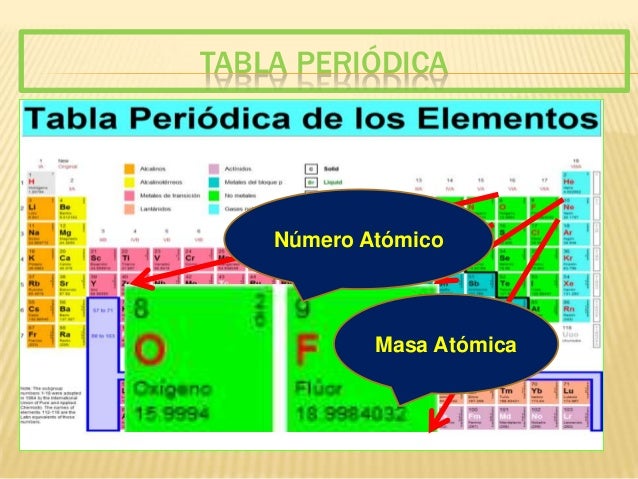
PASOS PARA SACAR LA MASA
MOLAR.
Paso 1:
Comprende qué es la masa
molar. La masa molar es la masa (en gramos) de un
mol de una sustancia. Utilizando la masa atómica de un elemento y
multiplicándola por el factor de conversión de gramos por mol (g/mol), puedes
calcular la masa molar de ese elemento.
PASO
2:
Averigua
la masa atómica relativa del elemento. La masa atómica relativa de un elemento es la
masa promedio, en unidades atómicas, de una muestra de todos sus isótopos.[3] Puedes
consultar esta información en una tabla periódica de elementos. Ubica el
elemento y busca el número que aparece debajo del símbolo de ese elemento. No
es un número entero, tendrá valores decimales.
Por ejemplo, la masa atómica relativa del hidrógeno
es de 1,007; la del carbono es de 12,0107; la del oxígeno es de 15,9994; y la
del cloro es de 35,453.
PASO 3:
Multiplica la masa atómica relativa por la constante de masa molar. Esta constante se define como
0,001 kg por mol o 1 gramo por mol. Al multiplicar por esta constante, las
unidades atómicas se convierten a gramos por mol. Por lo tanto, la masa molar
del hidrógeno es de 1,007 gramos por mol; la del carbono es de 12,0107 gramos
por mol; la del oxígeno es de 15,9994 gramos por mol; y la del cloro es de
35,453 gramos por mol.
Algunos elementos solo se
encuentran en moléculas de 2 o más átomos. Esto quiere decir que si quieres
encontrar la masa molar de elementos que están compuestos de 2 átomos, como
por ejemplo el hidrógeno, el oxígeno o el cloro, tendrás que encontrar sus
masas atómicas relativas, multiplicarlas por la constante de masa molar y
luego multiplicar el resultado por 2.
Para el H2: 1,007 x 2 = 2,014 gramos por mol; para el O2: 15,9994 x 2 = 31,9988 gramos por mol; y para Cl2: 35,453 x 2 = 70,096 gramos por mol.
PASOS PARA SACAR LA MASA
MOLAR.
Paso 1:
Comprende qué es la masa
molar. La masa molar es la masa (en gramos) de un
mol de una sustancia. Utilizando la masa atómica de un elemento y
multiplicándola por el factor de conversión de gramos por mol (g/mol), puedes
calcular la masa molar de ese elemento.
PASO
2:
Averigua
la masa atómica relativa del elemento. La masa atómica relativa de un elemento es la
masa promedio, en unidades atómicas, de una muestra de todos sus isótopos.[3] Puedes
consultar esta información en una tabla periódica de elementos. Ubica el
elemento y busca el número que aparece debajo del símbolo de ese elemento. No
es un número entero, tendrá valores decimales.
Por ejemplo, la masa atómica relativa del hidrógeno
es de 1,007; la del carbono es de 12,0107; la del oxígeno es de 15,9994; y la
del cloro es de 35,453.
PASO 3:
Multiplica la masa atómica relativa por la constante de masa molar. Esta constante se define como
0,001 kg por mol o 1 gramo por mol. Al multiplicar por esta constante, las
unidades atómicas se convierten a gramos por mol. Por lo tanto, la masa molar
del hidrógeno es de 1,007 gramos por mol; la del carbono es de 12,0107 gramos
por mol; la del oxígeno es de 15,9994 gramos por mol; y la del cloro es de
35,453 gramos por mol.
Algunos elementos solo se
encuentran en moléculas de 2 o más átomos. Esto quiere decir que si quieres
encontrar la masa molar de elementos que están compuestos de 2 átomos, como
por ejemplo el hidrógeno, el oxígeno o el cloro, tendrás que encontrar sus
masas atómicas relativas, multiplicarlas por la constante de masa molar y
luego multiplicar el resultado por 2.
Para el H2: 1,007 x 2 = 2,014 gramos por mol; para el O2: 15,9994 x 2 = 31,9988 gramos por mol; y para Cl2: 35,453 x 2 = 70,096 gramos por mol.
Comentarios
Publicar un comentario