REACCIONES QUÍMICAS.
Antes de iniciar con las reacciones químicas es importante que nosotros sepamos como esta constituida la materia para que comprendamos como se llevan a cabo las transformaciones o reacciones químicas.
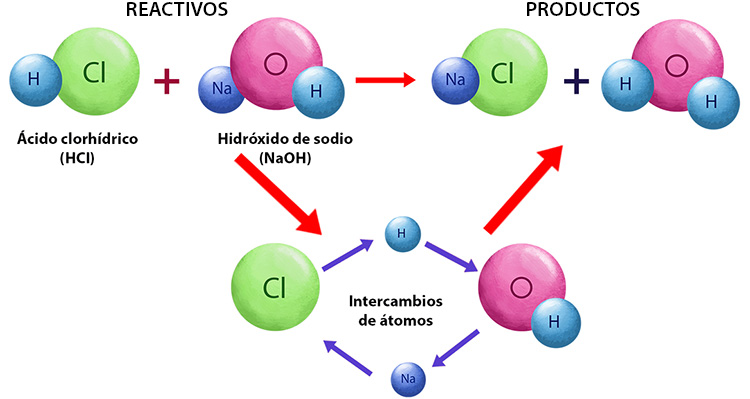
Una reacción química se produce cuando las sustancias participantes en ella se transforman en otras distintas. A las primeras se les llama reactivos y a las segundas productos. La masa de las sustancias participantes es la misma antes y después de la reacción, es decir, se conserva.

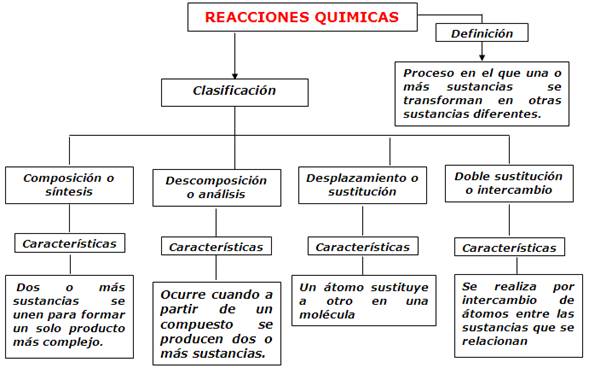
CLASIFICACIÓN DE LAS REACCIONES QUÍMICAS
PARA PRACTICAR EN AJUSTE DE REACCIONES QUÍMICAS.
Animación para aprender a ajustar (PHET)
ECUACIONES QUÍMICAS.
Una ecuación química es un enunciado que utiliza fórmulas químicas para describir las identidades y cantidades relativas de los reactivos y productos involucrados en una reacción química.
Para poder representar lo que ocurre en una reacción química mediante una ecuación, ésta debe cumplir con la Ley de la conservación de la materia y con la Ley de conservación de la energía. Es decir, la ecuación debe indicar que el número de átomos de los reactivos y productos es igual en ambos lados de la flecha y que las cargas también lo son. Dicho en otras palabras, se debe contar con una ecuación balanceada.


Participa 1 átomo de carbono, 1 átomo de
oxígeno y 6 átomos de hidrógeno.
oxígeno y 6 átomos de hidrógeno.
Si realizamos la suma de los átomos totales que participan del lado de reactivos observamos que es igual a 8 átomos:
Participa 1 átomo de
carbono, 1 átomo de oxígeno y
6 átomos de hidrógeno.
carbono, 1 átomo de oxígeno y
6 átomos de hidrógeno.
Si realizamos la suma de
los átomos totales que
participan del lado de productos
observamos que es igual a
8 átomos.
los átomos totales que
participan del lado de productos
observamos que es igual a
8 átomos.
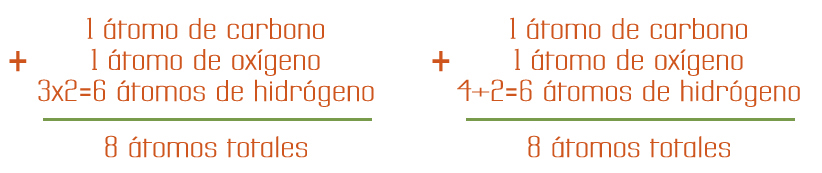
BALANCEO POR TANTEO.
Para balancear por este o todos los demás métodos es necesario conocer la Ley de la conservación de la materia, propuesta por Lavoisier en 1774. Dice lo siguiente "En una reacción química, la masa de los reactantes es igual a la masa de los reactivos" por lo tanto "La materia no se crea ni se destruye, solo se transforma"
Como todo lleva un orden a seguir, éste método resulta más fácil si ordenamos a los elementos de la siguiente manera:
Balancear primero
Metales y/o no metales
Oxígenos
Hidrógenos
De esta manera, nos resulta más fácil, ya que el mayor conflicto que se genera durante el balanceo es causado principalmente por los oxígenos e hidrógenos. Balancear por el método de tanteo consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento del que se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.

PASOS PARA BALANCEAR POR TANTEO:
1. Escribe la ecuación con la estructura básica para la reacción.
2. Cuenta los átomos de los elementos de los reactivos.
3. Cuenta los átomos de los elementos en los productos.
4. Cambia los coeficientes para que el número de átomos de cada elemento sea igual en ambos lados de la ecuación. PD. Nunca cambies un subíndice de una fórmula química.
5. Escribe los coeficientes en su razón más baja posible. Los coeficientes deben ser los números enteros más pequeños posibles.
6. Revisa tu trabajo. Asegúrate de que el número de átomos de cada elemento sea igual en ambos lados de la ecuación.
ejemplo:
Balancear la siguiente reacción: Al + HCl → AlCl + H2
Primero vamos a anotar la cantidad de átomos de cada elemento que tenemos en reactivos y productos.
| ATOMOS | REACTIVOS | PRODUCTOS |
| Aluminio (Al) | 1 | 1 |
| Cloro (Cl) | 1 | 1 |
| Hidrógeno (H) | 1 | 2 |
Se puede observar quetodos los atomos estan balanceados execpto el hidrogeno, por lo tanto procedemos a ajustar su coeficiente estequiometrico del lado de los reactivos.
Al + 2HCl → AlCl + H2
Realizamos el conteo otra vez.
| ATOMOS | REACTIVOS | PRODUCTOS |
| Aluminio (Al) | 1 | 1 |
| Cloro (Cl) | 2 | 1 |
| Hidrógeno (H) | 2 | 2 |
Se puede ver que falta balancear el cloro del lado de los productos, entonces le agregamos un 2 como coeficiente estequiometrico.
Al + 2HCl → 2AlCl + H2
Pero a simple vista se puede observar que hay dos atomos de aluminio en los productos, por lo que tambien deberiamos ajustar el coeficiente del aluminio en los reactivos.
2Al + 2HCl → 2AlCl + H2
Si hacemos el conteo podemos ver que la ecuación química ya esta balanceada.
| ATOMOS | REACTIVOS | PRODUCTOS |
| Aluminio (Al) | 2 | 2 |
| Cloro (Cl) | 2 | 2 |
| Hidrógeno (H) | 2 | 2 |
EJEMPLO NUMERO 2:
Realizar el balance químico de la siguiente
reacción: CH4 + O2 → CO2 + H2O
Dibujamos la tabla y comparemos la cantidad de átomos
presentes en reactivos y productos.
ATOMOS
|
REACTIVOS
|
PRODUCTOS
|
Carbono (C)
|
1
|
1
|
Hidrógeno (H)
|
4
|
2
|
Oxígeno (O)
|
2
|
3
|
Se puede notar como la cantidad de atomos de carbonos
ya se encuentra balanceada, por lo tanto, proseguimos a balancear lo atomos de
hidrogeno. Agregaremos un 2 como coeficiente estequiometrico delante de la
molecula del agua.
CH4 + O2 → CO2 + 2H2O
Hacemos la tabla una vez mas, y veremos que el
hidrógeno ya se encuentra balanceado. Pero ahora tendremos cuatro atomos de
oxigeno en los productos, y dos atomos de oxigeno en los reactivos.
ATOMOS
|
REACTIVOS
|
PRODUCTOS
|
Carbono (C)
|
1
|
1
|
Hidrógeno (H)
|
4
|
4
|
Oxígeno (O)
|
2
|
4
|
Agregaremos un dos delante de la molecula de oxigeno O2 en los reactivos y obtendremos la ecuación
correctamente balanceada.
CH4 + 2O2 → CO2 + 2H2O
ATOMOS
|
REACTIVOS
|
PRODUCTOS
|
Carbono (C)
|
1
|
1
|
Hidrógeno (H)
|
4
|
4
|
Oxígeno (O)
|
4
|
4
|
EL SIGUIENTE VÍDEO ES UN REFUERZO DEL MÉTODO POR TANTEO.
RESOLVER LOS SIGUIENTES EJERCICIOS.
Comentarios
Publicar un comentario