MASA ATÓMICA RELATIVA.
La masa atómica relativa se
define como la masa promedio de sus átomos (de un elemento químico) comparada
con la unidad de masa atómica. Masa atómica relativa. Desde el año 1961 fue
aprobado por los organismos internacionales correspondientes utilizar como
unidad de masa atómica la doceava parte de la masa del átomo de carbono.
La masa de los átomos es
extremadamente pequeña si se expresa en kilogramos y se hace muy difícil operar
con esos números, por ejemplo la masa de un átomo del isótopo más abundante del
oxígeno es 26,5606.10-27 kg. Por este motivo las masas atómicas se han
expresado en valores relativos a una unidad previamente escogida (y que ha
variado en diferentes épocas) de manera que los valores resultantes sean
números muchos más fáciles de operar.
Desde el año 1961 fue aprobado
por los organismos internacionales correspondientes utilizar como unidad de
masa atómica la doceava parte de la masa del átomo de carbono 12 por lo que su
valor es:
26.5606.10-27kg
________________ = 15.9949
1.66057.10-27kg

una vez se supo el número de partículas de un mol fue fácil medir la
masa absoluta de los átomos.
EJEMPLO
Calcular la masa de un átomo de C-12 sabiendo que, por convenio internacional, la masa de un mol de átomos de C-12 tiene una masa de 12,0000 g. A continuación calcular el valor de la unidad de masa atómica actual
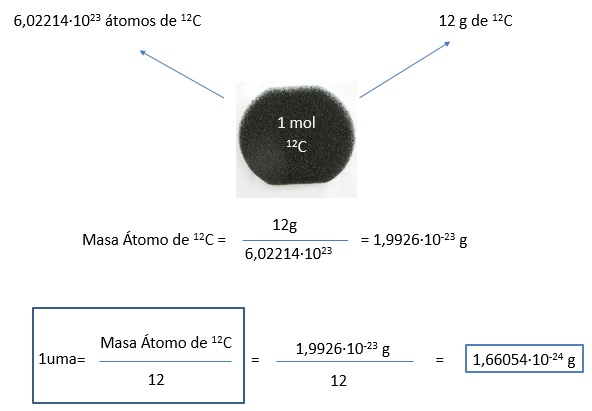
Una vez conocido el valor de la unidad de masa atómica, es fácil
determinar la masa absoluta de cualquier átomo a partir de un masa atómica
relativa.

Es curioso que la Química se construyó sin que se conocieran
las masas absolutas de los átomos. Los químicos dan más valor a las masas
atómicas (relativas).
Calcular la masa atómica relativa (peso atómico) de un
elemento.
Los químicos a menudo determinan las proporciones relativas
de isótopos de una muestra dada utilizando una herramienta especial llamada
"espectrómetro de masas". Sin embargo, si solo eres un estudiante de
química, esta información te la proporcionarán en los exámenes de la escuela
como valores ya determinados, obtenidos a partir de bibliografía científica.
Para los fines de este artículo, supón que vas a trabajar
con isótopos de carbono-12 y carbono-13.
2 Determina la abundancia relativa de cada isótopo en la muestra.
Dentro de un elemento dado pueden aparecer diferentes isótopos en diferentes proporciones. Estas proporciones casi siempre se expresan en porcentajes. Algunos isótopos son muy comunes, mientras que otros son muy poco comunes (a veces, la proporción es tan insignificante que casi no puede detectarse). Esta información puede determinarse a través de un espectrómetro de masas o desde un libro de referencia.
Imagina que la abundancia de carbono-12 es de 99 % y la abundancia de carbono-13 es de 1 %. Existen otros isótopos de carbono, pero existen en cantidades tan pequeñas que para este problema de ejemplo no se tomarán en cuenta.
Multiplica la masa atómica de
cada isótopo por su proporción en la muestra.
Multiplica la masa atómica de
cada isótopo por su porcentaje de abundancia (expresándolo como un número
decimal). Para convertir un porcentaje a número decimal, simplemente divídelo
por 100. La suma de los porcentajes convertidos siempre debe ser igual a 1.
En este ejemplo tienes carbono-12
y carbono-13. Si el carbono-12 representa el 99 % de la muestra y el carbono-13
representa el 1 % de la muestra, multiplica 12 (la masa atómica del carbono-12)
por 0,99 y 13 (la masa atómica del carbono-13) por 0,01.
Los libros de referencia muestran
proporciones en porcentajes basándose en las cantidades conocidas de isótopos
de un elemento. La mayoría de los libros de texto de química incluyen esta
información en una tabla al final del libro. También puedes utilizar un
espectrómetro de masas para obtener las proporciones de la muestra que vas a
analizar.
Suma los resultados.
Suma los resultados de las
multiplicaciones que obtuviste en el paso anterior. El resultado de la suma es
la masa atómica relativa de tu elemento. El valor promedio de masas atómicas de
los isótopos de tu elemento. Al hablar de un elemento en general, y no de
isótopos específicos de ese elemento, se utiliza este valor.
En el ejemplo anterior, 12 x 0,99
= 11,88 para el carbono-12, mientras que 13 x 0,01 para el carbono-13. La masa
atómica relativa del ejemplo es 11,88 + 0,13 = 12,01.




Comentarios
Publicar un comentario